|
|
确定对位红的小试生产方案
发布时间:2025/3/27 浏览次数:146
为了确定对位红的小试生产方案,下面将系统提供与对位红合成相关的理论基础知识参考资料供选用。 重氮化是芳香族伯胺与亚硝酸作用生成的重氮化合物的化学过程。重氮化合物可与酚类、芳胺等物质发生偶合反应生成偶氮染料等精细化学品。在有机合成反应中,重氮基还可以被其他取代基所置换,转化成合成所需要的官能团,用于制备多种重要的精细化学品的中间体。 重氮化合物的官能团为—N=N—或写成—N⁺=N—的形式,偶氮化合物的官能团也同样被写成—N=N一。二者区别在于,和重氮基中N₂ 基团两端相连的,一边是C 原子,另一边是其他种类的原子;而和偶氮基中N₂ 基团的两端相连的都是C 原子。如:
重氮基和偶氮基这两种官能团虽然写法一样,但是二者的化学性质完全不同。下面我们将重点讨论重氮化反应、偶合反应及重氮基的置换这三种反应。 一 、重氮化反应特点 (一)重氮化合物的由来 含有伯氨基的有机化合物在无机酸的存在下在0~5℃时与亚硝酸作用生成重氮化合物:
反应式(4-3)中的X为CI、Br、NO₃和HSO₄等,其中常用的是CI和HSO₄。C₆H₃—N=N—CI 称为氯化重氮苯,C₆H₅—N+=N-HSO₄ 称为重氮苯硫酸氢盐。 在上述反应中亚硝酸钠和氢卤酸先生成亚硝酸,再和含有伯氨基的化合物发生反应生成重氮化合物: 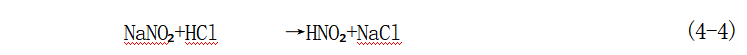
由于亚硝酸的化学性质很活泼极易分解,因此市场上没有这种原料供应,都是现制现用。 反应式(4-3)中的—Ar 包含芳环和芳杂环,不包含脂肪链和脂环链。由于脂肪族伯胺生成的重氮化合物极不稳定,易分解放出氮气而转变成碳正离子R*,且所生成的碳正离子R⁺ 稳定性也很差,容易发生取代、重排、异构化和消除等反应之后得到成分复杂的产物,因此没有实用价值。 CH₅—N⁴=N-BF4 称为重氮苯氟硼酸盐,其制法如式4-5所示,反应温度同样为0~5℃的低温条件。
由芳环伯胺和芳杂环伯胺的重氮化合物转变成的重氮正离子和强酸负离子生成的物质 Ar—N₂X在酸性溶液中相对稳定且易溶于水,在水溶液中以离子的状态存在,具有无机盐的性质,因此又被称为重氮盐。但重氮盐对光不稳定、在光照下易分解,因此可用作感光材 料,特别是作为感光复印纸里面的添加剂。 由于重氮盐易溶于水,因此所制备的重氮盐混合液是否澄清透明,常作为衡量生成重氮化合物的反应正常发生的标志之一。重氮盐在低温水溶液中一般比较稳定,但仍具有很高的 反应活性。工业生产中通常不必分离出重氮盐结晶,而是用其水溶液进行下一步偶合反应或 加氢还原反应等。 (二)重氮化合物的应用 重氮盐能发生置换、还原、偶合、加成等多种反应。因此通过重氮盐可以进行许多有价值的转化反应。 1.生产偶氮染料
重氮盐经偶合反应制得的偶氮染料,其品种居现代合成染料之首。它包括了适用于各种用途的几乎全部色谱。例如:对氨基苯磺酸重氮化后得到的重氮盐与2-萘酚-6-磺酸钠偶合,得到食用色素黄6。
2.生产药物中间体 例如,重氮盐还原制备芳肼类化合物:
芳肼类化合物的生产可以采用连续化生产方式,产率较高,接近理论量。又如,重氮盐置换得对氯甲苯中间体: 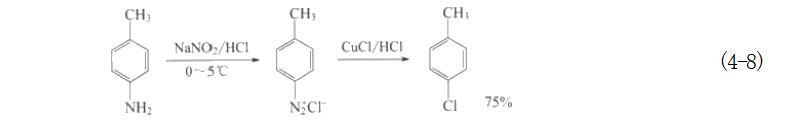
若用甲苯直接氯化,产物为邻氯甲苯(沸点159℃)和对氯甲苯(沸点160℃)的混合物。二者物理性质相近很难分离。 由此可见,利用重氮盐的活性,可转化成许多重要的、用其他方法难以制得的产品或中间体,这也是在精细有机合成中重氮化反应被广泛应用的原因。
二 、偶合反应特点 以芳香族重氮盐为原料所发生的偶合反应可分为两类:一类是重氮盐和芳胺或酚通过发生偶合反应转化为偶氮基或通过还原反应生成肼基,反应过程中氮原子不脱落,因此又称为保留氮反应;另一类是重氮盐和CuX 、CuCN、乙醇等发生反应,重氮基被其他如卤原子、腈基、羟基等的基团所置换,同时脱落两个氮原子放出氮气的反应,又称为放氮反应。下面 先来学习偶合反应中的保留氮反应。 1.偶合反应的过程
反应式(4-6)中的第二步、反应式(4-32)、反应式(4-33)和反应式(4-41)中的第二步,所发生的均为偶合反应。芳香族重氮盐和酚类化合物发生偶合反应的方程式如下:
反应式中的芳香族重氮化合物称为重氮组分,酚或芳胺称为偶合组分。常用的偶合组分有酚类(如苯酚、萘酚及其衍生物),芳胺类(如苯胺、萘胺及其衍生物),氨基萘酚磺酸类[如H 酸、J 酸、γ酸等,结构如式(4-10)所示],活泼亚甲基化合物(如乙酰基苯胺)等。
H酸、J 酸和γ酸都是生产染料的重要原料,可生产酸性大红G、活性橙、偶合反应过程直接深棕M 等各色染料。 2.偶合反应终点的判断
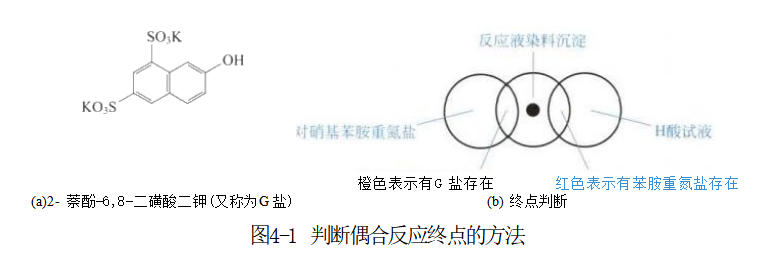
偶合反应进行时要不断检查反应液中重氮组分和偶合组分存在的情况。一般要求在反应终点重氮组分消失,剩余微量的偶合组分。如,判断苯胺的氯化重氮盐和G盐[2-萘酚-6,8-二磺酸二钾,属于酚类,为偶合组分,其结构如图4-1(a)所示]发生的偶合反应是否已经到了反应终点的方法,如图4-1(b)所示:用玻璃棒蘸取反应液滴在白色滤纸上,染料沉淀洇湿滤纸出现一个无色润圈,其中溶有重氮组分或偶合组分;用对硝基苯胺重氮盐溶液在润圈边滴上1滴,也生成润圈,若反应液中仍有G盐(即偶合组分)存在,则两润圈相交处出现橙色,若没有G 盐存在则不显色;同样以H 酸溶液在润圈的另一边也滴1滴来检查,若两润圈相交处出现红色,则表示反应液中还有苯胺的重氮盐组分存在,若没有则也不显色。
如此每隔数分钟检查一次,直至反应液中重氮盐组分完全消失(即滴H 酸试液在两润圈处不显色)且仅余微量偶合组分(即滴对硝基苯胺重氮盐试液后两润圈相交处显橙色)为止。
有时重氮盐本身的颜色较深,溶解度不大,偶合速率很慢,在这种情况下,如果用一般指示剂效果并不明显,需要采用更活泼的偶合组分如间苯二酚或间苯二胺作指示剂。
偶合反应生成的染料溶解度如果太小,滴在滤纸上不能得到无色润圈,在这种情况下可以先在滤纸上放一小堆食盐,将反应液滴在食盐上,染料就会沉淀生成无色润圈了;也可以取出少量反应液置于小烧杯中,加入食盐或乙酸钠盐析,然后进行点滴试验,就可得到明确指示。
三、重氮基的置换 重氮盐性质活泼,本身的使用价值并不高,干燥时还容易爆炸,但是重氮盐在一定条件下可被其他基团取代生成一些有使用价值的化合物,同时释放出氮气。常见的是将重氮基置 换为—X (包括—F 、—Cl 、-Br 、—D 、—CN 、—OH 、—H 、—SH (巯基)等。
通过此法可用来合成其结构和苯环上发生亲电取代反应时定位规律相悖的(当芳环上 已有邻、对位定位基时,要求所引入的基团是在其间位;或者当芳环上已有间定位基时,要求所引入的基团偏偏要在它的邻位或对位),或者是采用其他方法很难引入某种取代基的化合物,在药物中间体的合成中具有重要意义。但是应该指出的是,重氮盐转化反应的产率一般都不太高,产率一般在40%~80%,主要是因为重氮盐的化学性质太活泼、副反应太多。
(一)重氮基置换成卤代基
芳伯胺经重氮化和卤素置换反应后,—NH₂即转化为—X 。用此法可把卤原子引入芳环中的指定位置,没有其他异构体或多卤化物等副产物。重氮基置换成不同卤原子时,所采用 的方法各不相同。
1.重氮基置换成—Cl和— Br
芳伯胺的氯化重氮盐在Cut 的催化作用下,—N₂CI 置换成—Cl 、—Br 和—CN 的反应称为桑德迈尔(Sandmeyer) 反应。具有实际意义的例子是碱性染料中间体2,6-二氯甲苯的制备。
将重氮盐溶液加到氯化亚铜盐酸溶液中,控制反应温度在40~60℃,反应完毕,蒸出二氯甲苯,分出水层,将油层用硫酸洗、水洗和碱洗后得粗品,再进行分馏得到2,6-二氯甲苯成品。 如果不用上述路线生产2,6-二氯甲苯,比较容易想到的是以下两种合成路线:①烷基甲苯氯化法。以甲苯为原料经氯化反应获得2,6-二氯甲苯。但是此法容易生成对氯甲苯、2,4-二氯甲苯、2,3-二氯甲苯、2,5-二氯甲苯和3,4-二氯甲苯等多种副产,由于它们沸点接近,需要用高效精密精馏、冷冻、吸收等特殊方法分离,因此成本高、产率低、副产多。②甲苯 连续氯化法。如果以对叔丁基甲苯或对异丁基甲苯为原料进行氯化,氯原子被引入甲基的两 个邻位上得到2,6-二氯甲苯,但是脱叔丁基或脱异丁基反应这一步所使用的催化剂存在寿命短的问题且反应条件相对苛刻。 另外,还有使用对甲苯磺酰氯定向氯化法等合成2,6-二氯甲苯的路线,但是都存在生产成本高、“三废”量大、副反应多等缺陷。综合评判下来,还是式(4-11)的合成路线最具实用价值。 2.重氮基置换成—I 由重氮盐置换成碘代芳烃,可直接用碘化钾或碘和重氮盐在酸性溶液中加热即可。用碘置换的重氮盐制备一般在稀硫酸中进行,如式(4-12)所示。若用盐酸则其中的部分—Cl 会取代重氮基生成氯化副产。
3.重氮基置换成—F
氟化物在药物生产中应用广泛,如广谱抗菌药诺氟沙星和氟康唑,以及治疗关节炎的药物氟比洛芬等,还有杀蚊剂四氟甲醚菊酯的结构式里面也含有氟原子。
重氮盐与氟硼酸盐反应,或芳伯胺直接与亚硝酸钠和氟硼酸进行重氮化反应,均能生成不溶于水的重氮氟硼酸盐(复盐)。此重氮盐性质稳定,过滤干燥后,再经加热分解(有时在氟化钠或铜盐存在下加热),可得氟代芳烃。此反应称为希曼 (Schiemann) 反应。
重氮氟硼酸盐的热分解必须在无水的条件下进行,否则易生成酚类副产。但是,干燥的重氮盐又容易爆炸,细思恐极。所以希曼反应在工业化大生产中的应用价值不大,仅用于实验室小试研究。工业上需要得到大量的氟化物时,一般是以氯化或溴化物为原料,和KF等氟化试剂发生取代反应后得到(详见“项目七医药中间体正溴丁烷的生产”中相关内容)。
(二)重氮基置换成氰基
重氮盐与氰化亚铜的复盐反应,重氮基可被氰基(-CN) 置换,生成芳腈。如一种可用于治疗Ⅱ型糖尿病新药的中间体2-氟-4-硝基苯甲腈的合成。
关于2-氟-4-硝基苯甲腈的合成路线,一般有以下几条:①以2-氟-4-硝基甲苯为原料经氧化后生成2-氟-4-硝基苯甲酸,由2-氟-4-硝基苯甲酸继续发生酰基化和脱水反应生成2- 氟-4-硝基苯甲腈。该方法使用了毒性较强、价格较贵的草酰氯、正己烷、三氟乙酸酐等原料。②以2-氟-4-硝基苯甲酸先转化成酰氯,然后再和氯化铵、三氯氧磷等反应生成2-氟-4- 硝基苯甲腈。这种方法所选用的原料2-氟-4-硝基苯甲酸不易得到。③以2-氯-4-硝基苯甲腈为原料,与KF以DMF 为溶剂发生氟取代反应生成2-氟-4-硝基苯甲腈。这种方法同样存在原料2-氯-4-硝基苯甲酸不易购得的缺陷。④以溴苯为原料,先硝化生成2,4-二硝基溴苯,然后发生氰化反应生成2,4-二硝基苯甲腈,最后与KF以TMAF为相转移催化剂发生氟取代反应生成2-氟-4-硝基苯甲腈。这种方法原料的转化率相当低,大约只有60%,且还有少量的2,4-二氟苯甲腈副产物生成。反应式(4-14)所示的合成路线具有工艺设备简单、反应条件温和、产品纯度好、使用的大多数原料毒性较低、操作简便、生产成本低和适合推广应用等特点,适合工业化生产。
(三)重氮基置换成羟基
重氮基被羟基置换的反应称为重氮盐的水解反应。其反应属于S、1历程,当将重氮盐在酸性水溶液中加热煮沸时,重氮盐首先分解为芳正离子,后者受到水的亲核进攻,而在芳环上引入羟基。
由于芳正离子非常活泼,可与反应液中其他亲核试剂相反应,为避免生成氯化副产物, 芳伯胺重氮化要在稀硫酸介质中进行。为避免芳正离子与生成的酚氧负离子反应生成二芳基 醚等副产物,最好将生成的可挥发性酚,立即用水蒸气蒸出,或向反应液中加入氯苯等惰性溶剂,使生成的酚立即转入到有机相中。 为避免重氮盐与水解生成的酚发生偶合反应生成羟基偶氮染料,水解反应要在40%~50%的硫酸中进行。通常是将冷的重氮盐水溶液滴加到沸腾的稀硫酸中。温度一般在102~145℃。
以反应式(4-15)中的起始邻甲氧基苯胺为原料生产邻甲氧基苯酚时,还会发生以下副反应: (四)重氮基置换成H原子
将重氮盐用适当的温和的还原剂进行还原时,可使重氮基置换成—H (脱氨基反应)并放出氮气。比较常用的还原剂是乙醇、次磷酸(H₃PO₂) 和异丙醇等,用Cu或Cu²+作催化剂。 (五)重氮基置换成巯基 重氮盐与一些低价含硫化合物相作用可使重氮基被巯基置换。将冷的重氮酸盐水溶液倒入40~45℃的乙基磺原酸钠水溶液中,分离出的乙基磺原酸芳基酯在氢氧化钠水溶液中或稀硫酸中水解即得到相应的硫酚。
另一种方法是将冷重氮盐酸盐水溶液倒入冷的Na₂S₂-NaOH水溶液中,然后将生成的二硫化物Ar—S—S—Ar进行还原,也可制得相应的硫酚。
四、重氮基的还原
对重氮盐中的两个氮原子进行还原可制得芳肼化合物。方法是将芳伯胺制成重氮盐后,
用亚硫酸盐[(NH₄)₂SO₃]及亚硫酸氢盐(NH₄HSO₃)1:1 的混合液进行还原,然后进行酸性水解而得芳肼盐类。芳肼化合物在药物合成和染料合成中有较广泛的用途。
此法实际是亚硫酸盐的硫原子上一对孤对电子向氮正离子的亲核进攻,生成偶氮磺酸盐,该反应在较低温度即可很快进行,故称冷还原。
随后,偶氮磺酸盐与亚硫酸氢盐进行亲核加成而得芳肼二磺酸盐。此步反应温度较高,称为热还原。
芳肼二磺酸盐的水解反应,是在pH<2 的强酸性水介质中,在60~90℃加热数小时完成。
重氮盐还原成芳肼的操作大致如下:在反应器中先加入水、亚硫酸氢钠和碳酸钠的混合液,保持 pH=6~8, 在一定温度下向其中加入重氮盐的酸性水溶液、酸性水悬浮液或湿滤饼,保持一定的pH值;然后逐渐升温至一定温度,保持一定时间;最后加入浓盐酸或硫酸,再升至一定温度,保持一定时间,进行水解-脱磺基反应,即可得芳肼。芳肼可以盐酸盐或硫酸盐的形式析出,也可以芳肼磺酸内盐形式析出,或二者以水溶液形式直接进行下一步反应。
|