|
|
确定乙酰苯胺的小试生产方案
发布时间:2025/3/26 浏览次数:168
含氧羧酸去掉—OH 之后剩余的部分基团称为酰基。如 。酰基化(酰化)反应指的是有机化合物分子中与C原子、N 原子、0 原子或S 原子相连的H 被酰基所取代的反应。氨基中N 原子上的H 被酰基所取代的反应叫作N- 酰化反应,生成的产物是酰 胺;C 原子上的H 被酰基所取代的反应叫作C- 酰化反应,生成的产物是醛、酮或羧酸。芳香族化合物在催化剂作用下发生的C- 酰基化反应,由于最初是在1877年由巴黎的法国化学家傅列德尔(Friedel) 和美国化学家克拉夫茨(Crafts) 两人发现的,因此又被称为傅列德尔-克拉夫茨(Friedel-Crafts) 酰基化反应,简称为傅氏 酰基化反应;羟基0原子上的H 被酰基取代的反应叫作O- 酰化反应,由于生成的产物是酯,因此也叫作酯化反应。 由于一NH₂或—OH等官能团与酰化剂作用可以转变为酰胺或酯,所以引入酰基后可以改变原化合物的功能。如染料分子中氨基或羟基在酰化前后,其色光、染色性能和牢度指标均有所改变;有些酚类用不同羧酸酯化后会产生不同的香气;在医药分子中引入酰基可以改变其药性。
酰基化的另一作用是提高游离氨基的化学稳定性或反应中的定位性能,满足合成工艺的要求。如有的氨基物在反应条件下容易被氧化,酰化后可以增强其抗氧性;有些芳氨在进行硝化、氯磺化、氧化或部分烷基化之前常常要把氨基进行“暂时保护”性酰化,反应完成后再将酰基水解掉(想一想,如果芳胺在发生氧化反应之前不保护氨基,将会如何)。如: 一 、酰基化试剂 常用的酰化剂主要有:①酰氯。如乙酰氯、苯甲酰氯、对甲苯磺酰氯、光气、三氯化磷、三聚氯氰等。②酸酐。如乙酸酐、顺丁烯二酸酐、邻苯二甲酸酐等。③羧酸。如甲酸、乙酸、草酸等。④酰胺。如尿素和N,N-二甲基甲酰胺等;⑤羧酸酯。如氯乙酸乙酯和乙酰乙酸乙酯等。⑥其他。如乙烯酮、双乙烯酮、二硫化碳等。最常用的酰化剂是酰氯、酸酐和羧酸这三种。 二 、N- 酰基化方法 N-酰化是制备酰胺的重要方法。被酰化的物 质可以是脂肪胺,也可以是芳胺。N-酰化属于酰化剂对氨基上氢的亲电取代反应,反应的难易与酰化剂的亲电性及被酰化氨基上孤对电子的活性有关。 1.用羧酸的N-酰化 羧酸是最廉价的酰化剂,用羧酸酰化是可逆过程。
为了使酰化反应尽可能完全,并使用过量不太多的羧酸,必须除去反应生成的水。如果反应物和生成物都是难挥发物,则可以不断地将反应生成的水蒸出;如果反应物能与水形成共沸混合物,冷凝后又可与水分层,则可以采用共沸蒸馏,冷凝后使有机层返回反应器。也 可以加苯或甲苯等与水形成共沸混合物帮助脱水。少数情况可以加入化学脱水剂如P₂O₅ 和PCl₃等。 乙酰化,不论是永久性还是暂时保护性目的,都是最常见的酰化反应过程。由于反应是可逆的,一般要加入过量的乙酸,当反应达到平衡以后逐渐蒸出过量的乙酸,并将水分带出。如合成乙酰苯胺时将苯胺与过量10%~50%的乙酸混合,在120℃(标准状态下乙酸的沸点为118℃)回流一段时间,使反应达到平衡,然后停止回流,逐渐蒸出过量的乙酸和生成水,即可使反应趋于完全。
邻位或对位甲基苯胺,以及邻位或对位烷氧基苯胺,也可以用类似的方法酰化。甲酸在暂时保护性酰化时常常使用,用过量的甲酸与芳胺作用。 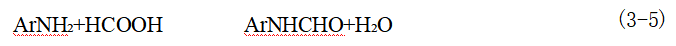
反应是在保温一段时间以后,真空下在150℃把生成水全部蒸出,反应即可完成。
合成苯甲酰苯胺时,由于反应物沸点都较高,可以采用高温加热除水的方法。
2.用酸酐的N- 酰化 酸酐是比酸活性高的酰化剂,但比酸贵,多用于活性较低的氨基或羟基的酰化。常用的酸酐是乙酸酐和邻苯二甲酸酐。用乙酸酐的N-酰化反应如下:
式中 ,R,可以是氢、烷基或芳基; R₂ 可以是氢或烷基。由于反应不生成水,因此是不可逆的。乙酸酐比较活泼,酰化反应温度一般控制在20~90℃。乙酸酐的用量一般只需过量5%~10%即可。 在胺类发生酰化反应时可用硫酸或盐酸作催化剂,碱性较强的胺酰化时一般不需要加催 化剂。伯胺和仲胺都能与乙酸酐反应,脂肪族伯胺与乙酸酐反应时主产物是N,N- 二乙酰胺;芳香族伯胺与乙酸酐反应的主产物是一酰化物,芳胺长时间与乙酸酐作用也可以得到二乙酰化物,但它在水中不稳定,容易水解脱去一个酰基。 苯胺与水混合物在常温下滴加乙酸酐即可进行酰化反应并放出热量,物料搅拌冷却后即可析出乙酰苯胺。
间苯二胺与等物质的量的盐酸作用,生成间苯二胺的单盐酸盐,然后控制在40℃以下 加入过量5%的乙酸酐,将得到间乙酰氨基苯胺的盐酸盐。
将H- 酸悬浮在水中,用NaOH 调节pH 为6.7~7. 1,在30~50℃滴加稍过量的乙酸酐可以制得N-乙酰基-H-酸。
酚类用酸酐酰化可以用酸催化,或在碱性水溶液中以酚盐形式参加酰化,也可以在无催化剂的情况下反应。水杨酸用乙酸酐酰化可以不加催化剂,将水杨酸与过量10%左右的乙酸酐,在60~70℃反应后,用上一批酰化反应后的乙酸母液稀释冷却后,析出结晶,过滤后用乙酸洗去未反应的水杨酸,干燥后即得粗产品乙酰水杨酸(阿司匹林,化学名称为邻乙酰氧基苯甲酸)。
对甲酚在磷酸催化下与乙酸酐作用得乙酸对甲基苯酯。反应后蒸出乙酸,用氯仿萃取并用稀碱洗出未反应的甲酚,蒸出氯仿后,减压蒸馏,取83~84℃/0.8~0.9kPa的馏分,产率为90%~94%。
β-萘酚用乙酸酐进行乙酰化时,可以在碱性水溶液中进行。 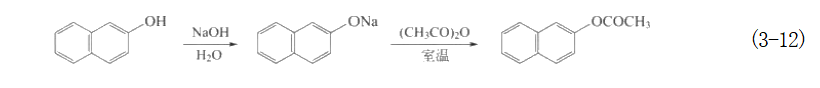
3.用酰氯的N-酰化 酰氯是最强的酰化剂,适用于活性低的氨基或羟基的酰化。常用的酰氯有长碳链脂肪酸酰氯、芳羧酰氯、芳磺酰氯、光气等。用酰氯进行N-酰化的反应通式如下:
上式中的R 表示烷基或芳基,Ac 表示各种酰基,此类反应是不可逆的。 酰氯都是相当活泼的酰化剂,其用量一般只需稍微超过理论量即可。酰化的温度也不需太高,有时甚至要在0℃或更低的温度下反应。 另外,酰化产物通常是固态,所以用酰氯的N- 酰化反应必须在适当的介质中进行。如果酰氯的N- 酰化速度比酰氯的水解速度快得多,反应可在水介质中进行。如果酰氯较易水解,则需要使用惰性有机溶剂,如苯、甲苯、氯苯、乙酸、氯仿、二氯乙烷等。 由于酰化时生成的氯化氢与游离氨结合成盐,降低了N- 酰化反应的速度,因此在反应过程中一般要加入缚酸剂来中和生成的氯化氢,使介质保持中性或弱碱性,并使氨保持游离 状态,以提高酰化反应速度和酰化产物的产率。但是,介质的碱性太强,会使酰氯水解,同时耗用量也增加。常用的缚酸剂有:氢氧化钠、碳酸钠、碳酸氢钠、乙酸钠及三乙胺等有机叔胺。但是,酰氯与氨或易挥发的低碳脂肪胺反应时,则可以用过量的氨或胺作为缚酸剂。在少数情况下,也可以不用缚酸剂而在高温下进行气相反应。
4.用其他酰化剂的N-酰化 (1)用三聚氯氰酰化三聚氯氰可以看作是三聚氰酸的酰氯,也可以看作是芳香杂环的氯代物。三聚氯氰分子中与氯原子相连的碳原子都有酰化能力,可以置换氨基、羟基、巯基等官能团上的氢原子,可以合成大量具有功能性的精细化学品,它们的结构通式可表示如下:
X₁ 、X₂ 、X₃可分别代表—OH 、—SH 、—NH₂ 和—SR 等官能团,这些精细化学品包括活性染料、水溶性荧光增白剂、表面活性剂及农药等,随着三聚氯氰生产技术的进步,其下游精细化工产品数量不断增加。 三聚氯氰分子上的三个—Cl都可参加反应,但它们的反应活性不同,因为它们连在共轭体系中。第一个—Cl 被亲核试剂取代后,其余两个—Cl 的反应活性将明显下降,同理,两个—CI被取代后,第三个—Cl 的反应活性将进一步下降。利用此规律,控制适当的条件,可以用三种不同的亲核试剂置换分子中三个—Cl。 三个—Cl 被逐个取代主要是通过控制反应温度来实现的。实践证明,在水介质中 反应活性表现在温度上的差异是:第一个—Cl 在0~5℃就可以反应,第二个 —Cl 在 40~45℃比较合适,第三个—Cl 则在90~95℃才能反应。在某些有机溶剂中反应温度可以提高。 三聚氯氰在水中溶解度较小,多数反应是将三聚氯氰悬浮在水介质中参加反应,必要时还可以加入表面活性剂或相转移催化剂。也可以在有机溶剂中进行,如丙酮-水、氯仿- 水等。 在水介质中酰化将遇到酰化剂的水解问题,因为水也是亲核试剂。三聚氯氰在中性介质中性质比较稳定,随着介质酸度和碱度的增加,氯的反应活性增加,水解速度也要增 加。碱度增加使羟基负离子增加,从而加快了水解。酸度对反应活性的促进是由于质子与 环上氮原子结合,增加了氮原子的吸电子性,从而增加了碳原子上的部分正电荷,使反应活性增加。 因此,正确地控制介质的pH 是提高产品质量和产率的关键,缚酸剂多使用氢氧化钠或碳酸钠水溶液,也可以使用碳酸氢钠或氨水。 (2)用光气酰化光气是碳酸的酰氯,由于羰基的作用使得两个氯都比较活泼,既可以和氨基作用,也可以和羟基作用,它与两个氨基作用可以得到脲衍生物。
光气与一分子胺或酚作用得到相应的甲酰氯RNHCOCl 或ArOCOCl 。得到的取代的甲酰氯与第二分子胺或酚作用则得到不对称的光气衍生物。 用光气作酰化剂制造的产品有三类,一是脲衍生物,二是氨基甲酸衍生物,三是异氰酸酯类。 在水溶液中,于较低温度下向芳胺中通入光气,可得脲衍生物(猩红酸)。它是常用的染料中间体。
低温下在有机溶剂中光气与胺类或酚类反应得到取代的甲酰氯,如芳胺在甲苯或氯苯中低温通入光气则发生以下反应:
胺类气体在较高温度下,短时间内与光气作用然后快速冷却或用冷的溶剂吸收也可以得到氨基甲酰氯。
合成异氰酸酯是将胺类溶在有机溶剂中,先在较低温度下通入光气,再在较高温度下脱除氯化氢。例如,在80℃将光气通入十八胺与氯苯混合物中,然后在130℃左右脱除氯化氢。 2,4-二氨基甲苯首先在有机溶剂中与光气作用,然后加热脱除氯化氢得到甲苯二异氰酸酯。它是合成黏合剂及塑料的重要原料。
(3)用二乙烯酮酰化二乙烯酮也叫双乙烯酮,室温下为无色透明液体,具有强烈的刺激性,其蒸气催泪性极强。它是由乙酸在700~800℃的高温下裂解为乙烯酮,再在-15℃下用二乙烯酮吸收、室温下双聚合而制得。它成本低、反应活性高,可在低温水介质中使用;酰化时间短、产率高、产品质量好。如:
反应中二乙烯酮的用量为理论用量的1.05倍,产率高于95%。 5.酰基的水解 酰胺基可以在酸或碱催化下水解,这是暂时保护性酰化的后续工序。
酰化物既可以在稀酸中水解,也可以在稀碱中水解。它们各有优缺点,碱性水解对设备的腐蚀性小,但生成的胺类和酚类在碱性介质中高温下容易被氧化,不如在酸中稳定。而稀酸对设备的腐蚀性要比碱严重得多,在较浓的酸中腐蚀性较小。
三 、C- 酰基化方法 C- 酰化反应指的是碳原子上的氢被酰基所取代的反应。而傅氏酰基化反应主要用于制备芳酮、芳醛以及羟基芳酸。 1.用羧酸酐的C-酰化反应 用邻苯二甲酸酐进行环化的C-酰化反应是精细有机合成的一类重要反酰基化反应过程应。酰化产物经脱水闭环制成蒽醌、2-甲基蒽醌、2-氯蒽醌等中间体。邻苯甲酰基苯甲酸的合成反应如下:
首先将邻苯二甲酸酐与AlCl₃ 在过量6~7倍的苯作溶剂下反应,然后将反应物慢慢加到水和稀硫酸中进行水解,用水蒸气蒸出过量的苯。冷却后过滤、干燥,得到邻苯甲酰基苯甲酸。然后将邻苯甲酰基苯甲酸在130~140℃浓硫酸中脱水闭环得到蒽醌。 2.用酰氯的C- 酰化反应 萘在催化剂AlCI₃作用下,用苯甲酰氯进行C-酰化反应,其反应式为:
在上述反应中过量的苯甲酰氯既作酰化剂又作溶剂。C- 酰化反应生成的芳酮与三氯化 铝的配合物需用水分解,才能分离出芳酮,水解会释放出大量热量,所以将酰化物放入水中时,要特别小心以防局部过热。 3.用其他酰化剂的C- 酰化反应 如果芳环上含有羟基、甲氧基、二烷氨基、酰氨基,在C- 酰化时会发生副反应。为了避免副反应的发生,通常选用温和的催化剂,例如无水氯化锌,有时也选用聚磷酸等。如间苯二酚与乙酸的反应:
生成的2,4-二羟基苯乙酮是制备医药的中间体。 四、O-酰基化方法 O- 酰基化反应形成的产物为酯,因此又称为酯化方法。工业上制造羧酸酯的方法主 要有两类,即醇(或酚)与各种酰化剂的反应的酯化法和羧酸与醇、酸、酯等反应的酯交换法。 1.以醇(或酚)为原料,与各种酰化剂反应的酯化法 此类反应常用酰化剂有:羧酸、酸酐、酰卤、酰胺、腈、醛、酮等。其反应通式为: 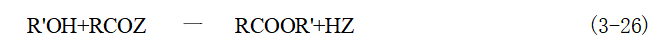
R'可以是脂肪族或芳香族烃基,即R'OH 可以是醇或酚;RCOZ 为酰化剂,可根据实际 需要选择;R 和R'可以是相同的或者是不同的烃基。 (1)酰氯法酰氯和醇(或酚)反应生成酯的反应通式为: 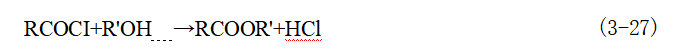
酰氯与醇(或酚)的酯化具有如下特点:①酰氯的反应活性比相应的酸酐强,远高于相应的羧酸,可以用来制备某些羧酸或酸酐难以生成的酯,特别是与一些空间位阻较大的叔醇进行酯化。②酰氯与醇(或酚)的酯化是不可逆反应,一般不需要加催化剂,反应可在十分 缓和的条件下进行,酯化产物的分离也比较简便。③反应中通常需使用缚酸剂以中和酯化反应所生成的氯化氢。因为氯化氢不仅对设备有腐蚀,而且还可能与活泼性醇(如叔醇)发生诸如取代、脱水和异构化等副反应。 常用于酯化的酰氯有有机酰氯和无机酰氯两类。常用的有机酰氯有:长碳脂肪酰氯、芳羧酰氯、芳磺酰氯、光气、氨基甲酰氯和三聚氯氰等,常用的无机酰氯主要为磷酰氯,如 POCl₃ 、PSCl₃ 、PCl₃ 、PCl₅等。用酰氯的酯化需在缚酸剂存在下进行。常用的缚酸剂有碳酸 钠、乙酸钠、吡啶、三乙胺或N,N- 二甲基苯胺等。为避免酰氯在碱存在下分解,缚酸剂通常采用分批加入或低温反应的方法,脂肪族酰氯活泼性较强,容易发生水解。因此,当酯化反应需要溶剂时,应采用苯、二氯甲烷等非水溶剂。 用各种磷酰氯制备酚酯时,可不加缚酸剂,允许氯化氢存在,而制取烷基酯时就需要加入缚酸剂,防止氯代烷的生成,加快反应速度。 由于酰氯的成本远高于羧酸,通常只有在特殊需要的情况下,才用酰氯合成酯。 (2)酸酐法羧酸酐是比羧酸强的酰化剂,适用于较难反应的酚类化合物及空间位阻较 大的叔羟基衍生物的直接酯化,此法也是酯类的重要合成方法之一,其反应过程为: 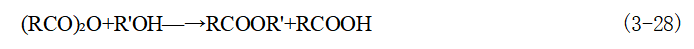
反应中生成的羧酸不会使酯发生水解,所以这种酯化反应可以进行完全。羧酸酐可与叔醇、酚类、多元醇、糖类、纤维素及长碳链不饱和醇(沉香醇、香叶草醇)等进行酯化反应,例如乙酸纤维素酯及乙酰水杨酸(阿司匹林)就是用乙酸酐进行酯化大量生产的。 常用的酸酐有乙酸酐、丙酸酐、邻苯二甲酸酐、顺丁烯二酸酐等。 用酸酐酯化时可用酸性或碱性催化剂加速反应。如硫酸、高氯酸、氯化锌、三氯化铁、吡啶、无水乙酸钠、对甲苯磺酸或叔胺等。酸性催化剂的作用比碱性催化剂强。目前工业上使用最多的是浓硫酸。 在用酸酐对醇进行酯化时,反应分为两个阶段,第一步生成物为1mol酯 (单酯)及1mol酸,反应是不可逆的;第二步则由1mol酸再与醇脱水生成酯(双酯),反应与一般的羧酸酯化一样,为可逆反应,需要催化剂及较高的反应温度,并不断地去除反应生成的水。 目前,工业上广泛采用苯酐与各类醇反应,以制备各种邻苯二甲酸酯。邻苯二甲酸酯类 是塑料工业广泛使用的增塑剂。例如,邻苯二甲酸二丁酯(DBP)的合成:
当双酯的两个烷基不同时,应使苯酐先与较高级的醇直接酯化生成单酯,然后再与较低级的醇在硫酸催化下生成双酯。 (3)羧酸法又称直接酯化法,用羧酸和醇反应。由于所用的原料醇与羧酸均较容易获得,所以是合成酯类最重要的方法。羧酸法中最简单的反应是一元酸与一元醇在酸催化下的酯化,得到羧酸酯和水,这是一个可逆反应。 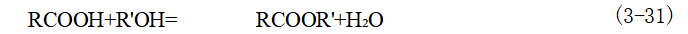
一般常用的酯化催化剂为:硫酸、盐酸、芳磺酸等。采用催化剂后,反应温度在70~150℃即可顺利发生酯化。也可采用非均相酸性催化剂,例如活性氧化铝、固体酸等,一般都在气相下进行酯化。 酯化反应也可不用催化剂,但为了加速反应的进行,必须采用200~300℃的高温。如果在生产工艺过程对产品纯度要求极高,而采用催化剂时又分离不净,则宜采用高温无催化剂酯化工艺。 (4)腈醇解法此法特别适用于制备多官能团的酯,工业上较为常用。 
有机玻璃单体甲基丙烯酸甲酯就是由羟基腈用甲醇和浓硫酸处理,同时发生脱水、水解、酯化而得的。
2.以羧酸酯为原料,与醇、酸、酯等反应生成另一种羧酸酯的酯交换法 该法是原料酯与醇、酸或其他酯分子中的烷氧基或烷基进行交换,生成新的酯的反应。此法有醇解法、酸解法和互换法三类。当用酸对醇进行直接酯化不易取得良好效果时,常采用酯交换法。 (1)醇解法也称作酯醇交换法。一般此法总是将酯分子中的伯醇基由另一较高沸点的伯醇基或仲醇基所替代。反应用酸作催化剂。
(2)酸解法也称作酯酸交换法。此法常用于合成二元羧酸单酯和羧酸乙烯酯等。
(3)互换法也称为酯酯交换法。此法要求所生成的新酯与旧酯的沸点差足够大,以便于采用蒸馏的方法分离。
这三种类型的酯交换都是利用反应的可逆性实现的,其中以互换法应用最为广泛。一个最典型的工业过程是用甲酸与天然油脂进行醇解以制得脂肪酸甲酯。后者是制取脂肪酸和表面活性剂的重要原料。 3.其他成酯方法 除上述方法外,酯化还有加成酯化法、羧酸盐与卤代烷反应成酯、羧酸与重氮甲烷反应形成甲酯等方法。 (1)加成酯化法包括烯酮与醇的加成酯化和烯、炔与羧酸的加成酯化。 ①烯酮与醇的加成酯化。乙烯酮是由乙酸在高温下热裂解脱水而成。它的反应活性极高,与醇类反应可以顺利制得乙酸酯。
对于某些活性较差的叔醇或酚类,可用此法制得相应的乙酸酯;含有氢的醛或酮也能与乙烯酮反应生成烯醇酯。如:
工业上还可用二乙烯酮与乙醇加成反应制得乙酰乙酸乙酯。
②烯、炔与酸加成酯化。烯烃与羧酸的加成反应如下:
羧酸按马氏规则加成,烯烃反应次序为:(CH₃₂C=CH₂>CH₃CH=CH₂>CH₂=CH₂。
炔烃也能与羧酸加成生成相应的羧酸烯酯,如乙炔与乙酸加成酯化可得到乙酸乙烯酯。 (2)羧酸盐与卤代烷反应成酯将羧酸的钠盐与卤代烷反应也可生成酯,此法常用于苯甲型卤化物的成酯。如:
|