|
|
确定苯胺的小试生产方案
发布时间:2025/3/24 浏览次数:138
为了确定苯胺的小试生产方案,下面将系统提供与苯胺合成相关的理论基础知识参考资料供大家选用。 还原反应是有机合成中最广泛应用的单元反应之一。广义地讲,在还原剂的参与下,能使某原子得到电子或使电子云密度增加的反应被称为还原反应;狭义地讲,即在有机分子中 增加氢原子或减少氧原子或者两者兼而有之的反应,被称为还原反应。还原反应在精细有机合成中占有重要的地位,通过还原反应可以制得一系列产物。如由硝基类化合物还原得到的芳胺,被广泛用于合成各种染料、农药和塑料等化工产品,由醛、酮、酸还原可制得相应的醇或烃类化合物,由醌类化合物还原还可得到相应的酚类等。 在表2-2中列出了常见的能被还原的官能团及其相对应主要还原产物。另外,此表中的 官能团是根据发生还原反应由易到难的程度按序排列的。在相同条件下,酰卤最容易被还原成伯醇,其次是硝化物被还原成胺,再次是炔烃被还原成烯烃等,最难发生还原反应的是羧酸被还原成伯醇。 表2-2 常见的能被还原的官能团及其相对应的主要还原产物
根据使用不同的还原剂和操作方法,还原反应可分为催化加氢、化学还原和电解还原等。但由于电解还原反应在工业上应用范围不广,尚存在不少技术瓶颈有待突破,因此我们将重点学习工业上应用较为广泛的两种方法——催化加氢和化学还原。在此基础上,对电解还原法做个了解。催化加氢和化学还原相比,其优点是:①反应活性高、应用范围广,能使一些用化学还原剂难于还原的化合物很好地发生氢化反应;②副反应少、产品质量好、产率 高;③“三废”量少,属绿色、清洁化生产工艺;④催化剂寿命长、消耗定额低,H₂ 比化学还原试剂价格便宜,故规模化生产其生产成本较低。因此,催化加氢被越来越广泛使用。 一 、催化加氢 为了加快反应速率并使反应向着产物方向进行,加氢反应通常要用催化剂。不同类型的加氢反应选用催化剂不同,同一类反应选用的催化剂不同反应条件也有很大差异。为了获得经济的加氢产物,选用的催化反应条件应尽量温和,催化剂的寿命要长,价格要尽可能便宜,并且尽量避免高温、高压等苛刻反应条件。
在催化剂的存在下,有机化合物与H₂ 发生的反应称为催化氢化反应。催化氢化按反应结果可分为催化加氢和催化氢解。其中催化加氢指含有不饱和键有机化合物在催化剂作用下与H₂反应、使不饱和键全部或部分加氢的反应,其应用范围很广,烯烃、炔烃、硝基化合物、醛、酮、腈等均可采用此法还原。如:
而催化氢解指含有碳杂键的有机物在催化剂作用下与H₂ 反应、使碳杂键断裂分解成为两种氢化产物的反应。常见的反应有脱卤氢解、脱苄氢解、脱硫氢解和开环氢解等。如: 
催化加氢根据物料的聚集状态又分为非均相催化氢化和均相催化氢化两种。非均相催化氢化反应中使用的催化剂(如Pt、Pd、Ni等)为固相,原料及产物为液相或气相,各属于不同的相态催化反应,至少存在两种相态,如气-固、液-固或气-液-固相态;而均相催化氢化反应中使用的催化剂一般为过渡稀有金属铑(Rh)、钌(Ru)和铱(Ir)的三苯膦配合物,如氯化三(三苯基膦)合铑(Ph₃P)₃—RhCl等,这些配合物能溶于液态的反应介质中,均呈液相状态分布。由于非均相催化氢化反应在工业上的应用范围要比分离和回收均较为困难的均 相催化氢化反应广泛得多,因此下面重点学习和讨论非均相催化氢化的相关内容。
(一)非均相催化氢化中的催化剂 1.催化剂的形状
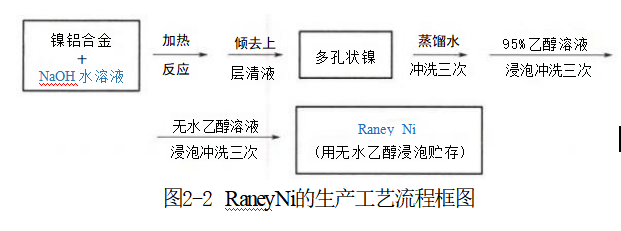
工业固体催化剂的形状和尺寸是根据具体的反应和反应器的特征而决定的。大多数固体催化剂为规则的颗粒状,一般用打片法或挤条法合制成。催化剂大多数为直径几毫米至十几 毫米的圆柱形或单孔环形柱(其外观有点像圆柱状的猪饲料),如图2-1(a)所示。催化剂内含丰富细孔,孔径的尺寸为纳米至微米级,如图2-1(b)所示。近年来还开发出了多种薄壁异形催化剂,如车轮形、舵轮形或多通孔形等。 2.催化剂的组成 固体催化剂一般由活性组分(又称为主催化剂)、助催化剂和载体三部分组成。其中主要起催化作用的是活性组分,常用的催化剂活性组分是金属或其氧化物。助催化剂虽然含量很少且对于反应没有活性或者催化活性也很小,但是加入后却能提高催化剂的活性、寿命和稳定性。催化剂大多数使用载体,称为负载型催化剂。载体是一些多孔性固体物质,使用载体是为了节约贵重材料(如Pd 和Pt 等)的消耗,即将贵重金属分散涂布在载体的表面以替代整块贵重金属材料的使用。载体的主要作用有:①作为骨架使活性组分及助催化剂涂布并均 匀分散在其表面,增大催化剂的内表面积,从而间接地提高催化剂的活性;②能提高催化剂活性组分的抗冲击强度、耐磨性以及抗压性;③在反应和再生过程中还能体现出足够的热稳定性。常用的载体有氧化铝、二氧化硅、碳化硅、活性炭、硅胶、硅藻土和沸石分子筛等。 如在丁烯脱氢制1,3-丁二烯时所使用的催化剂其组成为Fe₂O₃-CuO-K₂O-MgO 。其中,Fe₂O₃占催化剂中的质量分数为18.4%,CuO 为4.6%,K₂O 为4.6%,MgO 为72.4%。Fe₂O₃ 是催化剂中的活性组分,没有它则其他组分不起催化作用;助催化剂是CuO-K₂O, 可使活性组分不易中毒从而增加催化剂的使用寿命;MgO 是疏松多孔状的机械强度高的载体,为活性组分提供骨架支撑使其增加抗冲击强度。 3.催化剂的种类 加氢催化剂种类繁多,主要是元素周期表中的VⅢ族过渡金属元素(如Pt、Pd、Ni、Co和Rh 等)和第IB族、VB族中的Cu 、Mo 等。过渡金属原子的电子最外层有空的d 或f 轨道可以和底物分子结合成键,形成能垒较低的过渡态,从而降低整个反应路径的活化能,加速化学反应的进行。不同金属/活性炭型催化剂应用于硝基苯催化氢化生成苯胺时,其活性顺序为:Pt>Pd>Ni。 Ni催化剂主要有骨架Ni、载体Ni和还原Ni等。骨架Ni可用于硝基、烯键、炔键、醛酮的羰基、芳杂环、芳稠环、碳-卤键和硫-硫键等官能团的催化氢化,对苯环和羧基的氢化能力很弱,对酯基和酰胺中的羰基则几乎没有催化活性。Ni 的价格最便宜。 工业上应用范围较广的Raney Ni(雷内Ni, 又被称为骨架Ni 和活性Ni 等),其生产的原理为:以镍铝合金为原料,利用铝属于两性金属既能和酸反应又能和碱反应的特性(而镍属于碱金属,不能和碱发生反应)使铝原子生成了四羟基合铝酸钠溶于水溶液之后,在原合金中所占的位置被空置了出来形成孔洞,从而获得疏松多孔状结构的催化剂。其反应方程式为: 2Al+2NaOH+6H₂O=2Na[Al(OH)4]+3H₂t (2-4) 四羟基合铝酸钠,易溶于水 Raney Ni的生产工艺流程如图2-2所示。蒸馏水、95%乙醇和无水乙醇等溶剂需回收套用。
Pd催化剂主要有Pd/C 载体催化剂、还原Pd 黑和熔融PdO 等 。Pd/C 载体催化剂是最好的脱卤、脱苄基的催化剂,主要用于烯键、炔键、硝基和芳环侧链上的不饱和键发生氢化反应等,但是对于羰基、苯环和氰基几乎没有催化活性。 Pt催化剂的活性比Pd和Ni都强,反应条件温和,甚至在常温常压下都能使用,它除了骨架Ni催化剂所能应用的范围之外,还可以用于羧基、酰胺基和苄位结构发生氢化反应。 至于其他种类元素催化剂的催化活性,以甲酸催化分解为H₂和CO₂ 的反应为例,其催化活性如图2-3所示。图中的纵坐标反应温度TR越低、则表明催化剂的活性越高;图中的横坐标反应生成热代表催化剂吸附能力的强弱,催化剂吸附底物的能力越强、则反应生成热越大。催化剂的吸附能力太强、太弱都不好,至于为什么,请到后面“项目五香料β-萘乙醚的生产”所介绍的内容中寻找答案。 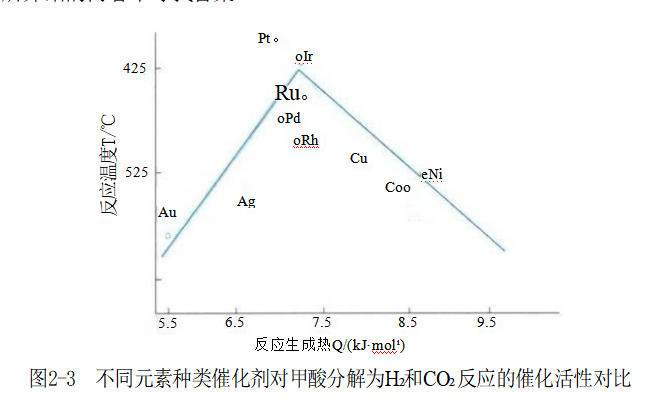
从图2-3中可知,适合做催化剂的金属元素主要集中在反应温度低且反应生成热居中的 部位,有Pt (铂)、Ir (铱)、Ru (钌)、Pd ( 钯 ) 和Rh ( 铑 ) 等 ,Cu (铜)的性质也可以,关 键还价廉,值得关注。 另外,催化剂的种类还可以根据形态来分类,主要分为金属及骨架催化剂、金属氧化物 催化剂、复合氧化物或硫化物催化剂,以及金属配合物催化剂等几类。 4.几种重要的催化剂 (1)金属及骨架催化剂加氢常用的金属催化剂有Pt 、Pd 和Ni 等。Ni 的催化效果虽然最差但价格便宜,所以使用量最大。金属催化剂需把金属载于载体上,载体通常是多孔性材料,如Al₂O₃ 、硅胶等,这样既节约金属又提高加工效率,并能具有较好的热稳定性和机械强度。由于多孔性载体比表面积巨大,传质速率快,所以也能提高催化活性。金属催化剂的特点是活性高,尤其是贵金属催化剂(如Pt 和Pd 等)在低温下即可进行加氢反应,而且几乎可以用于所有官能团的加氢反应。骨架催化剂与金属催化剂的特征基本相近,但其活性较高,常用于低温液相加氢反应。常见的有骨架Ni 、骨架Cu 、骨架Co 等,一般是将活性金属与Al 制成合金材料,然后用氢氧化钠溶出合金中的Al 即可得到海绵状的骨架催化剂。骨架Al 具有足够的机械强度及良好的导热性能。但由于其活性非常高,骨架Al 在空气中裸 露会产生自燃现象。 (2)金属氧化物催化剂常用的金属氧化物催化剂有: MoO, 、Cr₂O₃ 、ZnO 、CuO 和NiO 等。这类催化剂与金属催化剂相比,其活性较低,反应在高温、高压下才能保证足够的 反应速率,但其抗毒性较强,适用于CO 加氢反应。由于反应温度高,需要在催化剂中添加高熔点的组分以提高其耐热性。 (3)复合氧化物和硫化物催化剂为了改善金属氧化物催化剂的性能,通常采用多种氧化物混合使用,以使各组分发挥各自的特性且相互配合提高催化效率。金属硫化物主要有MoS₂ 、NiS₃ 、WS₂ 、Co-Mo-S 、Fe-Mo-S 等,其抗毒性强,可用于含硫化合物的加氢、氢解等反应,这类催化剂的活性较差,所需的反应温度也比较高。 (4)金属配合物催化剂此类加氢催化剂的活性中心原子主要为贵金属,如Ru 、Rh、Pd 等的配合物。另外也有部分非贵金属,如Ni 、Co 、Fe 、Cu 等的配合物。其特点是活性高、选择性好、反应条件较温和、抗毒性较强,因此适用性较广。但由于这类配合物是均相催化氢化反应的催化剂,反应时是溶解在反应液中的,催化剂的分离相对较困难,而且这类催化剂多使用贵金属,所以金属配合物催化剂应用的关键在于催化剂的分离和回收。 从以上的论述中可知,加氢反应所用的催化剂,通常活性大的容易中毒而且热稳定性较差,为了增加催化剂热稳定性可以适当地加入一些助催化剂和选用合适的载体,有些场合下用稳定性好而活性低的催化剂为宜。通常反应温度在150℃以下时,多使用Pd 、Pt 等贵金属催化剂,以及用活性很高的骨架镍催化剂;而在150~200℃反应时,常用Ni 、Cu 以及它们的合金催化剂;当反应温度高于250℃时,大多使用金属氧化物催化剂。 5.催化剂的用量 常用加氢催化剂的种类及其用量如表2-3所示。骨架Ni 催化剂由于合成及使用安全要求,用量以湿体积计,通常1mL 湿骨架Ni 约含有1.5g固体,一般操作中10%用量就足够了,但是当催化剂活性下降时其用量需要增加至20%左右。为了安全起见,某些商品骨架Ni 需经钝化处理,其用量为15%~20%。 表2-3常用加氢催化剂的种类及其用量
注:表中的用量是以被加氢化合物质量为基准的百分比。 除了催化剂的性质外,催化剂的用量也较为重要。实验室里的低压加氢反应中一般催化剂用得较多。而在大生产中,要对催化剂的用量加以控制以防止反应速率过快而导致温度失控,造成反应产物选择性下降甚至引发工业事故。在工业加氢工艺的连续操作中,催化剂的用量主要取决于反应的接触时间。此外,通过控制催化剂的用量有时也可以抑制副反应的发生。如在下述的反应中,用量为4%的催化剂铂-碳(吸附量为5%)可以防止苯环上溴的脱落。 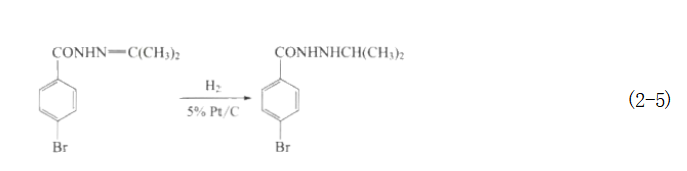
尽管增加催化剂用量可以提高加氢反应的速率,但反应速率增加的程度与催化剂的用量 不呈线性关系,如增加催化剂用量1倍则加氢反应速率可以提高5~10倍。 6.催化剂的几个技术指标 (1)比表面积比表面积指的是每克催化剂的表面积(包括内表面积和外表面积),用S, 表示,单位为m²·g¹ 。 常见的多孔催化剂其比表面积一般在10~900m²·g¹ 。 比表面积越大,则说明该催化剂能提供给原料吸附的面积越大,则在单位时间内发生催化氢化反应的概率越高,因此其催化活性越强。 (2)孔径除了少数如分子筛等物质以外,大多数催化剂内部的孔径大小呈不均匀分布状态。有的细孔的孔径为1~100nm, 有的粗孔的孔径为1~900 μm。 7.评判催化剂性能优劣的几个方面 (1)活性催化剂的活性工业上常用负荷来表示,又称为空间速率,即单位体积(或单位质量)催化剂在单位时间内转化原料(反应物)的数量,其单位为h¹。催化剂的活性大 小与比表面积成正比。表2-4是某些硝基化合物进行催化氢化反应时的催化剂负荷。 表2-4 某些硝基类化合物进行催化氢化反应时的催化剂负荷
应使实际负荷与额定负荷相当。否则若负荷太小达不到生产能力,负荷过大反应物又会转化不完全。 (2)选择性指在能够发生多种反应的反应系统中,催化剂促进某一种特定反应的性能。即实际生成的目的产物与所耗用的原料在理论上能生成同一产物的摩尔比。如果反应原料中混有多种组成,则应指明是对于哪一种原料组成而言的选择性。
在催化氢化反应中,Rh对可还原性基团具有较好的选择性。Rh催化剂在一定的条件下只催化还原硝基成氨基而不影响碳碳双键的还原。
催化剂的选择性越好,则加速主反应、抑制副反应的能力越强,主反应的产率越高。催化剂的选择性和它的组成、制造方法以及使用条件等因素有关。 (3)寿命金属催化剂的缺点是易中毒。它对原料中杂质(特别是硫、磷、砷等)的含 量要求严格,含有孤对电子的化合物都能使其失去催化活性而中毒。由于杂质中的孤对电子 会填满过渡金属的d 轨道形成强烈的吸附,活性中心被杂质占据,导致催化剂的活性下降甚 至完全丧失活性。中毒分为永久性中毒和暂时性中毒两种,当某些杂质强烈吸附在催化剂表 面而无法脱附时,则为永久性中毒。此时只能更换催化剂。为预防永久性中毒,需严格控制 原料中杂质的含量,如加工原油时应首先经过脱S 处理把其中硫化物的含量控制在ppm(μL·L) 数量级以下之后再催化加氢生成汽油、煤油和柴油等。如果能使用某些方法使某些杂质脱 附,让催化剂表面重新具备能提供原料分子吸附和发生化学反应场所的功能,则是暂时性中 毒了。如在使用过几次的催化剂表面容易形成积炭,可以通过燃烧的方法去除积炭后恢复催 化剂的部分活性,称为催化剂的再生。 根据催化剂的这种情况,人们设计出一些特定组成的催化剂使其完成特定的催化任务。如:Pd 是一种活性很强的催化剂,它能使炔烃通过催化氢化先还原成烯烃最终还原生成烷烃,但烷烃在有机合成中应用范围不如烯烃来得广泛,因此罗氏公司的化学家林德拉发明了一种催化剂,其组成为Pd-CaCO₃-PbO或Pd-BaSO₄-喹啉(其中Pd为活性组分,含量为5%~10%,CaCO₃ 为载体)。这种催化剂只能把炔烃通过顺式加氢生成烯烃而无法继续加氢生成烷烃,其中的PbO 或喹啉的作用就是使钯部分中毒降低其催化的活性,工业上广泛应用于药物和香料等化学品的生产,后来人们把这种组成的催化剂以发明者的名字来命名,称为林德拉催化剂。
一般情况下,工业上所使用的催化剂寿命一般在1~2年。 8.催化剂使用的安全事项 由于骨架Pt、骨架Ni等催化剂的比表面积巨大、催化活性很强,暴露在空气中极易发生自燃,因此在使用和储存过程中应避免暴露在空气中。活泼的骨架Ni一般需要浸于乙醇溶液中,少量催化剂在加料过程中溅落在设备周围时应特别小心,当溶剂挥发时骨架Ni催化剂可以自燃而引起火灾。新制得的骨架Ni等催化剂的存放期不宜超过6个月,以防氧化变质。催化剂可多次回收循环使用。当活性下降到一定程度之后的“废”催化剂也不能任意 丢弃,因为它的表面还吸附有活性氢,干燥后仍然会发生自燃,应把它们置于稀盐酸或稀硫酸中浸泡,使其完全失去催化活性。另外,催化剂已经投料使用完毕了的空桶需要及时清洗,投料过程中滴漏在反应器外部的和残留在催化剂包装筒外壁的液体都应及时用溶剂清洗干净。 从加料操作来说,一些密度较大的催化剂如骨架Ni、PtO₂ 等,能很快沉入溶剂中不会与空气接触,产生氧化的可能性较小。 但某些特别是以活性炭为载体的载体型催化剂如Pd/C, 由于其密度较小,易漂浮于溶剂表面。如果反应中采用易燃性低沸点溶剂,则漂浮于溶剂表面的催化剂就易被空气氧化而引起燃烧。
在进行低压加氢反应时,催化剂可以先加到乙醇或乙酸中,调匀后再将其加到反应容器 中,就可避免发生着火的危险。如果需要大量的催化剂时,则必须预先采用溶剂浸润后再分
批加料。若采用高沸点溶剂如乙二醇缩甲醚、二乙二醇缩甲醚等,几乎不会发生火灾危险。此外也可以采用惰性气体保护,将反应设备中的空气用惰性气体置换掉也可保证安全运行。
有些催化剂本身很稳定,如骨架Ni 、Cu-Cr 氧化物等,操作时的安全系数较高。但是这类催化剂的催化活性也相对较低。
(二)非均相催化氢化的反应过程
非均相催化加氢反应具有多相催化反应的特征。包括五个步骤:①反应物分子扩散到催化剂表面;②反应物分子吸附在催化剂表面;③吸附在催化 剂表面的反应物在催化剂的作用下发生化学反应生成产物分子并同样被催化剂表面所吸附;④吸附的产物分子从催化剂表面解吸;⑤产物分子通过扩散
离开催化剂表面,即扩散→吸附→反应→解吸→反扩散。其中:①和⑤为物理过程,②和④为化学吸附和解吸现象,③为化学反应过程。在以上五个步骤中②的速率最慢。由于催化剂表面上发生的氢化反应速率很快,因此整个非均相催化氢化反应的速率取决于其中最慢的步骤即②的速率。
(三)非均相催化氢化的反应类型
VⅢ族过渡金属元素的金属催化剂如 Pt 、Pd 、Ni 载体催化剂及骨架Ni 等,常用于炔烃和双烯烃选择加氢、油脂加氢等;金属氧化物催化剂,如氧化铜-亚铬酸铜、氧化铝-氧化锌-氧化铬催化剂等催化剂,常用于不饱和醛、酮、酯、酸及CO 等加氢生成不饱和伯醇或仲醇;金属硫化物催化剂如镍-钼硫化物等,常用于石油炼制中的加氢精制等。各种催化剂的反应条件及结果如表2-5所示。
表2-5各种催化剂进行催化氢化反应时的反应条件及结果
原料
催化剂
反应条件
反应结果
硝基化合物
Cu、骨架Ni等
20~80℃,0.1~1MPa
芳胺
不饱和醛、酮
金属氧化物
较低温度、较低压力
不饱和伯、仲醇
饱和醛、酮
负载型Ni、Cu、Cu-Cr等
50~150℃,1~2MPa
伯醇、仲醇
不饱和醛、酮
Pt、Ni、Cu或其他金属催化剂
一
饱和醛、酮,选择性 70%~80%
酚、芳醛、芳酮
骨架Ni
100~150℃,1~2MPa
环己醇、芳伯醇、芳仲醇
烯烃
Pt、骨架Ni、载体Ni、Cu-Cr、Zn-Cr等
100~200℃,1~2MPa
烷烃
不饱和醛、酮
金属或金属氧化物
较高温度、较强压力
伯醇、仲醇
腈
骨架Ni、Co、Cu等
100~250℃,1~5MPa
伯胺
不饱和酯
负载型Ni催化剂
100~250℃,2~5MPa
饱和酯(如人造奶油)
不饱和酯
ZnO-Cr₂O₃
一
不饱和醇
芳环(苯、萘等)
负载型Ni或Cr₂O₃等金属氧化物
120~200℃,2~7MPa
环烷烃
饱和脂肪酸
CuO-Cr₂O₃ 、Z nO-Cr₂O₃和 CuO-ZnO-Cr₂O₃等
250~350℃、
25~30MPa
脂肪醇
二 、化学还原 上面刚学完催化加氢反应相关知识,虽然这种还原方法有诸多优点,但是不可避免地也存在着诸多缺陷:①H₂ 属易燃易爆的气体,使用时存在一定的安全隐患;②主反应的选择性不如某些化学还原试剂那么具有针对性;③需要使用高压设备,存在一定的安全隐患,对操作人员的职业素养要求较高;④催化剂的合成、活化、回收和使用等技术含量高; ⑤ 耐高温、耐高压的生产设备一次性投资规模比较大。
主要的无机化学还原试剂有以下几种:①活泼金属及其合金,如锌粉、锡粒、金属钠和锌-汞齐等;②元素化合价处于低价态的化合物,如Na₂S, 等;③金属复氢合物,如NaBH₄ 和LiAlH₄ 等。 近年来出现一些对环境友好的化学还原试剂,如维C (又称抗坏血酸)、柠檬酸、茶多酚和壳聚糖等。 (一)在电解质溶液中用铁屑还原 在20世纪80年代,国内多以硝基苯为原料、采用铁粉的稀酸法将其还原生产得到苯 胺。但是随着人们的环保意识越来越强,这种生产方法由于污染严重(不仅产生大量酸性废液,还生成大量主要成分是氧化铁的固废——“铁泥”。这些露天堆放的“铁泥”吸附了原料硝基苯和产物苯胺,经雨水冲淋,这些有机物进入地下水管网系统,损害人们的身 体健康)且劳动强度大,因此这种生产方法逐渐被淘汰,取而代之的是我们前面刚学过的绿色、环保的催化加氢法。但目前国内外有极少数企业尚且还保留了铁粉还原生产工艺,其原因是,这些“铁泥”经恰当处理之后不但能获得当今电子工业发展中所需要的磁性材料,还能做成颜料。 在电解质溶液中的铁屑还原法一般采用间歇式操作,典型生产案例为由硝基苯生产苯胺。在还原锅中加入少量含胺废水、盐酸和少量铁屑,先生成电解质完成铁的预蚀,再通入蒸汽加热,然后分批加入硝基苯和铁屑。在反应刚开始时比较激烈,可以靠反应放出的热能保持沸腾。反应过程中用硫化钠溶液检验有无Fe²⁺ 存在,若无Fe²+存在则需补加酸。反应结束后加入纯碱使铁离子转变为氢氧化铁沉淀并使反应液呈碱性,最后使物料与“铁泥”分离后精制得到苯胺。 在我国,由于固废“铁泥”二次利用技术水平不过关,在江苏省人民政府于2018年8月发布的《江苏省产业结构调整限制、淘汰和禁止目录》中,明确表明“在电解质溶液中用 铁屑还原”法属于被淘汰类生产工艺;在2020年5月发布的《江苏省化工产业结构调整限制、淘汰和禁止目录(2020年本)》中则进一步限制、淘汰和禁止了一批污染大、能耗高、安全性差、毒性强的化工产品的生产。政府从监管层面引导化工工艺向绿色、环保的方向发展 (二)用锌粉还原 由于锌粉容易被空气氧化成膜而降低锌粉的还原活性,必须使用刚刚制得的锌粉。锌粉不宜存放时间过久以免失效。锌粉还原大多数是在酸性介质中进行的,最常用的是稀硫酸。当原料或还原产物难溶于水时,可加入乙醇或乙酸以增加其溶解度,有时也可根据实际情况加入一些甲苯等非水溶性溶剂。锌粉容易与酸反应放出H₂, 所以一般要用过量较多的锌粉。在少数情况下,也会需要用锌粉在强碱性介质中发生化学还原反应。锌粉的还原能力比铁粉强一些,最重要的是它没有类似“铁泥”的固废产生,因此它的应用范围比铁屑要来得广,但其价格要比铁屑贵得多。 1.将羰基还原成羟基 用锌粉的乙酸溶液,可以把酮还原成醇,继而发生酰基化反应成生成酯。 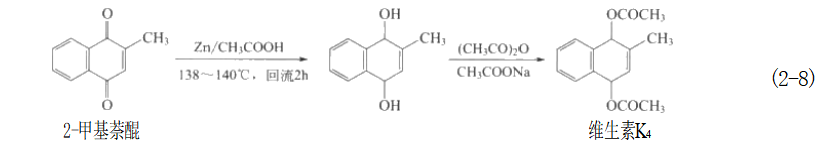
在这里使用锌粉还原法的优点是:羰基还原成羟基,和羟基发生乙酰化反应生成酯基可以在同一个反应器中完成即“一锅法”生成酯,不必分离出还原产物。 锌粉在NaOH 水溶液中,也可以将酮羰基还原成醇: 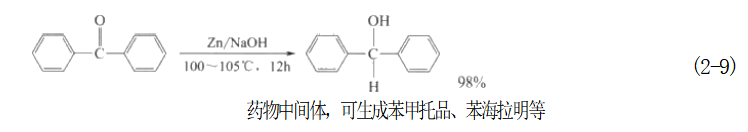
2.将羰基还原成亚甲基 在一定的条件下,锌粉的乙醚溶液在酸性条件下可以只把羰基还原成亚甲基而不影响其他官能团,甚至原料中有多个羰基的,可通过控制反应条件逐个地发生还原反应。此功能和锌-汞齐试剂 (Zn-Hg/HCl,用锌粉和5%~10%的氯化汞水溶液处理后而得)的类似。 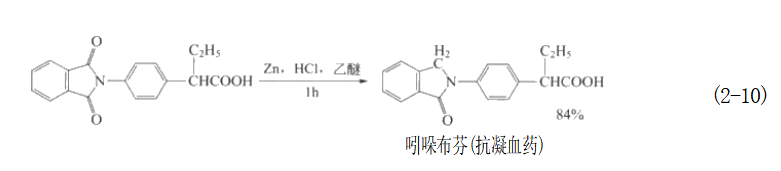
|