|
|
确定硝基苯的小试生产方案
发布时间:2025/3/17 浏览次数:163
为了确定硝基苯小试生产合成方法、原料投料的配方等方案,下面将系统提供与硝基苯合成相关的理论基础知识参考资料供大家选用。 硝化是向有机化合物分子中引入硝基(-NO₂)的化学过程。作为硝化反应的产物——硝基化合物,在燃料、香料、医药、农药等许多领域中都能找到它的应用实例。硝化反应是最普通和最早被发现的有机化学反应之一。早在1834年就有人用硝化方法合成了硝基苯。自1842年发现硝基苯可以还原成苯胺之后,硝化反应在有机化学工业中的应用和研究就迅速发展起来。近年来,关于芳烃硝化的反应研究与应用在国内外比较活跃。 工业上,脂肪族化合物的硝化很少应用,而芳香族硝基化合物及其还原产物(芳胺)则是有机合成的重要中间体。所以,向芳环或芳杂环上引入硝基是最重要的硝化反应。 ArH+HNO₃→ArNO₂+H₂O 在芳环上引入硝基,一是将其进一步转化成氨基,以制取芳胺类化合物;二是利用硝基的极性,使芳环上其他取代基活化,以促进亲核取代反应的进行;三是赋予一些精细化学品以某些特性,如加深染料的颜色,使药物的生理效应显著变异等。有些硝基化合物具有药理作用,如可缓解心绞痛的硝酸甘油。另外在国防工业上,一些硝基化合物可合成炸药,如TNT(2,4,6-三硝基甲苯)以及军用烈性炸药黑索金(即环三亚甲基三硝胺)等。 硝化方法按反应物的聚集状态分,可分为均相硝化和非均相硝化;若按反应介质分,又可分为在硝酸或硫酸以及有机溶剂中的硝化;如果按硝化剂分,则可分为稀硝酸硝化、浓硝酸硝化,在浓硫酸介质中的均相硝化、非均相混酸硝化以及在有机溶剂中的硝化等。不同的硝化剂,硝化能力不同,适用范围也不尽相同。所以,按照硝化剂分类,更能反映不同硝化方法的特点。下面将根据硝化剂分类,重点学习工业上最常用、最重要的非均相混酸硝化法。 一、硝化反应特点 硝化反应的特点可归纳为如下三点: ① 在进行硝化反应的条件下,反应是不可逆的; ② 硝化反应速率快,属于强放热反应,其放热量约为126kJ·mol¹; ③ 在多数场合下,反应物与硝化剂是不能完全互溶的,常常分为有机相(油层)和酸相 (水层)。 二、硝化反应方法 硝化的方法主要有以下四种。 (1)硝酸硝化稀硝酸硝化常用于某些容易反应的芳香族化合物,如酚类、酚醚类和某些N-酰基化的芳胺的硝化。反应在不锈钢或搪瓷设备中进行,硝酸过量10%~65%。浓硝酸硝化一般需要用过量许多倍的硝酸,目前只用于少数硝基化合物的合成。单纯使用硝酸作硝化剂的主要问题是在反应过程中硝酸会不断被硝化反应生成的水所稀释,导致硝化能力不断下降,使反应很快就达到化学平衡,使硝化作用不完全,因此硝酸的使用极不经济。所以工业上应用的较少。 (2)浓硫酸介质中的均相硝化当在反应温度下原料或硝化产物是固态时,就需要把原料被硝化物溶解在大量的浓硫酸中,然后加入硫酸和硝酸的混合物中进行硝化。这种方法只需要过量少许硝酸,一般产率较高,缺点是硫酸用量过大。 (3)非均相混酸硝化当在反应温度下,被硝化物和硝化产物是液态时,常常采用非均相混酸硝化的方法。通过强烈搅拌,使有机相被分散到酸相中以完成硝化反应。此法有许多优点,是目前工业上最常用、最重要的方法,也是我们讨论的重点。 (4)在有机溶剂中硝化对于在混酸中易被氧化或易分解的如胺类、酚类等化合物,可在乙酸酐、二氯甲烷或二氯乙烷等介质中用硝酸硝化。此法可避免使用大量硫酸作溶剂,工业上应用前景广阔。 三、硝化反应原理 (一)硝化剂 硝化剂是能够生成硝酰正离子(NO₂)的反应试剂,硝酰正离子(NO₂)就是将要引入底物生成硝基(-NO)的基团。硝化剂是以硝酸或氮的氧化物(N₂Os、N₂O₄)为主体,与强酸(H₂SO₄、HCIO₄等)、有机溶剂(CH₃CN、CH₃COOH等)或路易斯酸(BF₃、FeCI)等物质组成。工业上常用的硝化剂有不同浓度的硝酸、硝酸与硫酸的混合物(混酸)、硝酸盐与硫酸的混合物,以及硝酸的乙酸酐(或乙酸)溶液等。 1.硝酸 纯硝酸、发烟硝酸及浓硝酸很少离解,主要以分子状态存在,如75%~95%(质量分数)的硝酸中有99.9%呈分子状态。纯硝酸中有96%以上呈HNO₃分子状态,仅有约3.5%的硝酸经分子间质子转移,能离解成硝酰正离子(NO₂)。 2HNO₃ H₂NO₃+NO₃
H₂NO₃ H₂O+NO₂ 由式(1-3)平衡反应可知,水分的存在会促使反应左移,不利于NO₂的生成。 如果硝酸中的水分较多,如70%以下质量浓度的硝酸,则按式(1-4)进行离解,不能形成硝酰正离子,因此也就无法向底物中引入硝基(-NO₂)。
单纯用硝酸作硝化剂时,如式(1-1)所示,随着反应的进行会有水分生成,水分的出现对硝酸继续离解出NO₂不利,浓硝酸被稀释到70%左右时即失去硝化能力。因此很少采用单一的硝酸作为硝化剂,除非是反应活性较高的酚、酚醚、芳胺以及稠环芳烃的硝化。 2.混酸 混酸是浓硝酸或发烟硝酸和浓硫酸按一定比例组成的混合物。在硝酸中加入了供给质子能力较强的硫酸后,能大大提高硝酸分子离解成NO₂的程度。
HNO₃+2H₂SO₄NO₂+H₃O+2HSO₄ 实验表明,在混酸中增加硫酸浓度有利于NO₂的离解。硫酸浓度在75%~85%时,NO₂浓度很低,当硫酸浓度增加至89%或更高时,硝酸全部离解为NO₂,从而硝化能力增强。见表1-2。
表1-2由硝酸和硫酸配成的混酸中NO₂的含量
硝酸、硫酸和水的三元体系作硝化剂时,其NO₂浓度可用如图1-1所示的三角坐标图表示。由图可见,随着混酸中水的含量增加,NO₂的浓度逐渐下降,代表NO₂可测出极限的曲线与可发生硝化反应所需混酸组成极限的曲线基本重合。 除NO:是主要的硝化活泼质点外,还有H₂NO₃也是有效的活泼质点。稀硝酸硝化时还可能有NO*、N₂O₄或NO₂作为活泼质点,但反应历程有所不同。 3.硝酸盐与硫酸 硝酸盐与硫酸作用生成硝酸和硫酸盐,实质上是无水硝酸与硫酸的混酸。 常用的硝酸盐有硝酸钠、硝酸钾等。硝酸盐与硫酸的配比一般是(0.1~0.4):1(质量比)。按照这种配比,硝酸盐几乎全部能离解成NO₂,所以比较适合于苯甲酸、对氯苯甲酸等难以硝化的芳烃硝化。 NaNO₃+H₂SO₄HNO₃+NaHSO₄ 4.硝酸的乙酸酐溶液 研究表明,硝酸的乙酸酐溶液包含的组分,硝化能力较强,可在低温下进行硝化反应,适用于易被氧化和为混酸所分解的硝化反应。乙酸酐对有机物有着良好的溶解性,可使反应处于均相,其酸性很小。一些容易被混酸中硫酸破坏的有机物,可在此硝化剂中顺利地硝化。硝化反应生成的水可使乙酸酐水解成乙酸,所需硝酸不必过量很多。这种硝化剂既保留了混酸的优点,又弥补了混酸的不足,是仅次于混酸的常用硝化剂,被广泛用于芳烃、杂环化合物、不饱和烃化合物、胺、醇以及肟等的硝化。 硝酸在乙酸酐中可以任意比例混溶。常用的是含硝酸10%~30%的乙酸酐溶液。其配制应在使用前进行,以避免因放置过久产生四硝基甲烷而有爆炸的危险。 4(CH₃CO)₂0+4HNO₃---4d--C(NO₂)₄+7CH₃COOH+CO₂t
此外,硝酸与乙酸、四氯化碳、二氯甲烷或硝基甲烷等有机溶剂形成的溶液,也可以作为硝化剂。硝酸在这些溶剂中能缓慢产生NO₂,反应比较平和。 (二)硝化反应的历程 化学反应历程,又称为化学反应机理,指化学反应中的反应物转化为最终产物通过的途径,即反应物按什么途径、经过哪些步骤得到最终产物。通过了解化学反应历程,可以找到相应的主反应和副反应,从而找出决定反应速率的关键,达到生产中多、快、好、省的目的。
芳烃的硝化反应符合芳环上亲电取代反应的一般规律。以苯为例,其反应历程如下:
环上电子云密度较高的碳原子进攻,生成π-配合物,然后转变成σ-配合物,这是慢的一步;第三步是c-配合物脱去一个质子,形成稳定的硝基化合物,这一步是很快的。其中形成σ-配合物是硝化反应的控制步骤。 (三)硝化反应的动力学 1.均相硝化动力学
反应的第一步是硝化剂离解,产生硝酰正离子NO₂;第二步是亲电活泼质点NO₂向芳被硝化物与硝化剂、介质相互溶解形成均一液相称为均相硝化。硝基苯、对硝基氯苯、1-硝基蒽醌等在大大过量的浓硝酸中硝化属于均相硝化,硝化反应速率服从一级动力学方程式。
r=k[ArH] 式中的k是表观反应速率常数。在硫酸存在下的硝化,当加入的硫酸量较少时,硝化反应仍为一级反应,但硝化反应速率明显提高。当加入硫酸量足够大时,硫酸起到溶剂作用,硝酸仅作为硝化剂,此时表现为二级反应。 r=k[ArH][HNO₃]式中表观反应速率常数k值的大小与硫酸的浓度密切相关。当硫酸浓度在90%左右时,k值为最大。表1-3列出了一些有机物在不同硫酸浓度下的硝化速率常数。 表1-3一些有机物在不同硫酸浓度下的硝化速率常数(25℃)
2.非均相硝化动力学
反应的第一步是硝化剂离解,产生硝酰正离子NO₂;第二步是亲电活泼质点NO₂向芳 非均相硝化是由被硝化物(又称为底物)、硝化剂及溶剂构成有机相(油层)和酸相(水层)的液-液非均相反应过程。例如,苯、甲苯等的混酸硝化。以甲苯的一硝化反应为例,非均相硝化反应步骤为:①一甲苯通过有机相向相界面扩散;②甲苯由相界面扩散进入酸相;③甲苯在扩散进入酸相的过程中与硝酸发生硝化反应,生成一硝基甲苯;④生成的一硝基甲苯由酸相扩散至相界面;⑤一硝基甲苯由相界面扩散进入有机相;⑥硝酸从酸相向相界面扩散,在扩散途中与甲苯进行反应;⑦反应生成的水扩散到酸相;⑧某些硝酸从相界面扩散进入有机相。以上步骤构成了非均相硝化反应的总过程。影响非均相硝化反应速率的因素,有化学和传质两方面。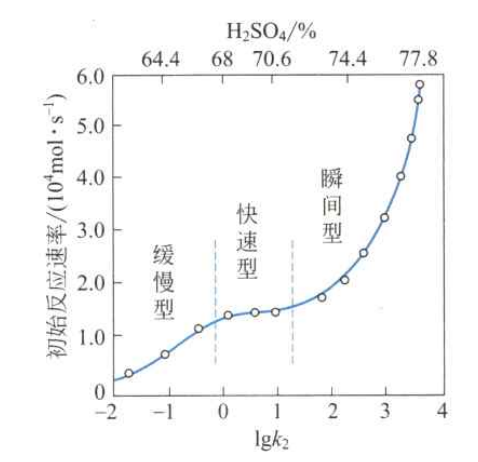
图1-2在无档板容器中甲苯的初始反应速研究表明非均相硝化反应主要在油水两相界面处或酸率与lgk的变化关系(25℃,2500r·min)相中进行,在有机相中反应极少(<0.001%),可忽
略。近年来通过对苯、甲苯和氯苯的非均相硝化动力学研究,认为硫酸浓度是影响非均相硝化反应的重要因素,并将非均相硝化反应区分为缓慢型、快速型和瞬间型三种动力学类型,如图1-2所示。它是根据动力学实验数据按甲苯一硝化的初始反应速率对lgk作图得到的曲线。图中还同时表示出相应的硫酸的浓度范围。 由图中曲线可以清楚地看出,非均相硝化反应的特点以及三种动力学类型的差异。 (1)缓慢型也称动力学型。反应速率是整个反应的控制阶段,反应主要发生在酸相中。其反应速率与酸相中芳烃的浓度和硝酸的浓度成正比。甲苯在62.4%~66.6%的H₂SO₄ 中的硝化属于这种类型。 (2)快速型也称慢速传质型。随着硫酸浓度的提高,酸相中的硝化反应速率加快。当甲苯从有机相传递到酸相的速率与其参加硝化反应而被移出酸相的速率达到稳态时,则反应 由动力学型过渡到传质型。其特征是反应主要在酸膜中或两相的边界层上进行。此时甲苯向酸膜中的扩散速率成为整个硝化反应过程的控制阶段,即反应速率受传质控制。其反应速率与酸相容积的交换面积、扩散系数和酸相中甲苯的浓度成正比。甲苯在66.6%~71.6%H₂SO₄中硝化属于这种类型。 (3)瞬间型也称快速传质型。硫酸浓度继续增加,硝化反应速率也不断加快。当硫酸浓度达到某一数值时,以致于使液相中的反应物不能在同一区域共存,反应在两相界面上发生。非均相硝化反应过程的总速率由传质速率所控制,其反应总速率与传质速率和化学反应 速率都有关。甲苯在71.6%~77.4%H₂SO₄ 中硝化时属于这种类型。 硝化过程中硫酸浓度不断被生成的水稀释,硝酸不断参与反应而消耗,故对硝化过程来说,不同的硝化阶段可归属于不同的动力学类型。如甲苯混酸硝化生产一硝基甲苯采用多釜 串联操作时,在第一硝化釜酸相中的硫酸、硝酸浓度都较高,反应受传质控制;而在第二硝化釜中,由于硫酸浓度降低、硝酸含量减少,反应速率受动力学控制。一般地,芳烃在酸相中的溶解度越大,则反应速率受动力学控制的可能性越大。 在影响非均相硝化反应速率的诸多因素中,硫酸的浓度较为重要。图1-2中表明甲苯在62.4%~77.4%H₂SO₄ 浓度范围内其非均相硝化表观反应速率常数k 值的增加幅度高达10⁵。 四 、引入硝基其他的方法 1.磺酸基的取代硝化 以易被氧化的酚或酚醚类芳香族化合物作原料发生硝化反应时, 一般不直接硝化,而 是通过先引入磺酸基后再硝化的方法。这是由于在苯环上引入磺酸基后电子云密度下降, 硝化的副反应可以被抑制一些。如用苯酚合成苦味酸(2,4,6-三硝基苯酚),如式(1-11) 所示。
当苯环上还有羟基(或烷氧基)及醛基时,也可先磺化后硝化以保护醛基不被氧化,如式(1-12)所示。 2.重氮基的取代硝化 邻二硝基苯和对二硝基苯不能由硝基苯直接硝化而得(你知道原因是什么吗?),但可以通过邻硝基苯胺或对硝基苯胺的重氮盐与亚硝酸钠反应得到。

五 、混酸硝化工艺计算 混酸硝化是工业上广泛采用的一种硝化方法,特别是用于芳烃硝化。混酸硝化的特点: ①硝化能力强,反应速率快,生产能力高;②硝酸用量接近于理论量,几乎全部被利用;③硫酸的热容量大,可使硝化反应平稳进行;④浓硫酸可溶解多数有机物,增加有机物与硝酸的接触使硝化反应易于进行;⑤混酸对铁的腐蚀性很小,可采用普通碳钢或铸铁作反应器。不过对于连续化装置,则需采用不锈钢或碳化硅等材质。一般的混酸硝化工艺过程如图1-3所示。
( 一 ) 混 酸 的 硝 化 能 力 混酸的组成标志着混酸的硝化能力,合理选择混酸组成对生产过程的顺利进行十分重要。工业上常用硫酸脱水值和废酸计算浓度数值的大小来表示不同组成混酸硝化能力强弱。 1.硫酸脱水值 硫酸脱水值是指硝化终了时废酸中硫酸和水的计算质量之比,也称作脱水值。用符号D.V.S.(dehydrating value of sulfuric acid的缩写)表示。 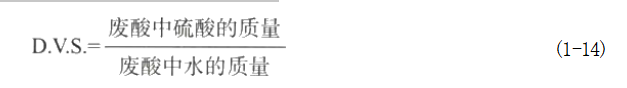
当已知混酸的组成和硝酸比时,脱水值的计算如下:设S和N分别表示混酸中硫酸和硝酸的质量分数,φ表示硝酸比(即硝酸与被硝化物的摩尔比),假设一硝化反应进行完全,且无副反应。若以100份混酸为计算基准, 则混酸组成中包含的水=100-S-N
当硝酸用量接近理论量,即φ≈1时,则上式可简化为: D.V.S.值的大小表示了混酸硝化能力的强弱。对于难硝化的物质,所需的D.V.S.值大;对于容易硝化的物质所用的D.V.S.值小。不同的硝化过程,对混酸的硝化能力的要求不同。否则,硝化能力太强,反应速率虽快,但是硝化副反应较多;若硝化能力太弱,则反应缓慢,反应不完全。所以,对于一个具体的硝化过程来说,选择适当的D.V.S.值是有必要的。 2.废酸计算浓度
废酸计算浓度是指在混酸硝化终了时,废酸中硫酸的浓度,也称作硝化活性因素,用符号EN.A.(factor of nitration activity的缩写)表示。 硝化终了后废酸的质量,包括混酸中的硫酸(即废酸中的硫酸)、混酸中的水分、反应后剩余的硝酸,以及硝化反应生成水的质量。 仍然以100份混酸(即:混酸中纯硫酸的质量+混酸中纯硝酸的质量+混酸中水的质 量=100)为计算基准,当φ≈1且同样假设一硝化反应进行完全(即反应后硝酸剩余量为0) 并且无副反应时:
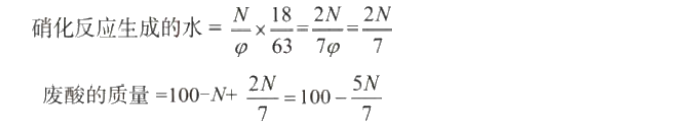
则
或
当φ≈1时,D.V.S.值和FN.A.值的互换关系如下:
或 由式(1-21)可见,当F.N.A.值一定时,给出一个硝酸浓度N 则有对应的硫酸浓度S。这说明满足相同废酸浓度的混酸组成是多样的。但并非所有混酸组成都有实际意义。表1-4 中给出了氯苯一硝化时选用的三种不同组成混酸的比较。该表中混酸I、混酸Ⅱ和混酸Ⅲ的组成不同,但其FN.A. 值和D.V.S.值都一样。当选择混酸I 时,硫酸用量最省但相比(即混酸与被硝化物的质量比,有时也称酸油比,“酸”指的是混酸、“油”指的是被硝化物)太小, 反应的温度难以控制,容易发生多硝化、氧化等副反应;当选择混酸Ⅲ时,混酸用量太大,因此生产能力相对较低且废酸量也大。所以,具有实用价值的是混酸Ⅱ的组成。 表1-4氯苯一硝化时选用三种不同组成混酸的比较
总之,为了保证硝化过程顺利进行,对于每个具体的硝化过程,都应通过实验来确定适宜的D.V.S.或FN.A. 值、相比、硝酸比和混酸组成。表1-5中所列的是某些重要硝化过程的技术数据。 表1-5某些重要硝化过程的技术数据
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||